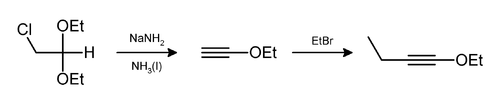Amida de sodio
| Amida de sodio | ||
|---|---|---|
 | ||
 Modelo de célula unitaria de amida sódica | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | NaNH2 | |
| Identificadores | ||
| Número CAS | 7782-92-5[1] | |
| ChEBI | 176791 | |
| ChemSpider | 21111834 22940, 21111834 | |
| PubChem | 24533 | |
| UNII | 5DB3G6PX9D | |
| Propiedades físicas | ||
| Masa molar | 39,008 g/mol | |
La amida sódica, comúnmente llamada sodamida (nombre sistemático: azanida sódica), es un compuesto inorgánico de fórmula NaNH2. Es una sal compuesta por el catión sodio y el anión azanida. Este sólido, peligrosamente reactivo frente al agua, es de color blanco, pero las muestras comerciales suelen ser grises debido a la presencia de pequeñas cantidades de hierro metálico procedentes del proceso de fabricación. Tales impurezas no suelen afectar a la utilidad del reactivo. El NaNH2 conduce la electricidad en estado fundido, siendo su conductancia similar a la del NaOH en un estado similar. El NaNH2 se ha empleado ampliamente como base fuerte en síntesis orgánica.
Preparación y estructura
[editar]La amida sódica puede prepararse mediante la reacción del sodio con gas amoníaco,[2] pero normalmente se prepara mediante la reacción en amoníaco líquido utilizando nitrato de hierro(III) como catalizador. La reacción es más rápida en el punto de ebullición del amoníaco, c. -33 °C. Se forma un electruro, [Na(NH3)6]+e−, como intermediario de la reacción.[3]
- 2 Na + 2 NH3 → 2 NaNH2 + H2
El NaNH2 es un material salino y, como tal, cristaliza como un polímero infinito.[4] La geometría sobre el sodio es tetraédrica.[5] En amoníaco, el NaNH2 forma soluciones conductoras, consistentes con la presencia de iones [Na(NH3)6]+ y NH−
2.
Usos
[editar]La amida sódica se utiliza principalmente como base fuerte en química orgánica, a menudo en disolución líquida de amoníaco. Es el reactivo de elección para el secado de amoníaco (líquido o gaseoso). Una de las principales ventajas del uso de la amida sódica es su relativamente baja nucleofilia. En la producción industrial de índigo, la amida sódica es un componente de la mezcla altamente básica que induce la ciclación de la N-fenilglicina. La reacción produce amoníaco, que suele reciclarse.[6]

Deshidrohalogenación
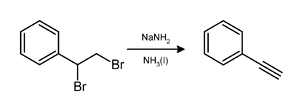
[editar]La amida sódica induce la pérdida de dos equivalentes de bromuro de hidrógeno de un dibromoalcano vicinal para dar un triple enlace carbono-carbono, como en una preparación de fenilacetileno.[7] Normalmente, dos equivalentes de amida sódica producen el alquino deseado. Se necesitan tres equivalentes en la preparación de un alquino terminal porque el CH terminal del alquino resultante protona una cantidad equivalente de base.
El cloruro de hidrógeno y el etanol también pueden eliminarse de esta forma,[8] como en la preparación del 1-etoxi-1-butino.[9]
Reacciones de ciclización
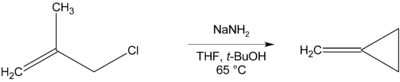
[editar]Cuando no hay β-hidrógeno que eliminar, pueden formarse compuestos cíclicos, como en la preparación del metilenciclopropano que se describe a continuación.[10]
De forma similar pueden formarse ciclopropenos,[11] aziridinas[12] y ciclobutanos.[13]
Desprotonación de ácidos de carbono y nitrógeno
[editar]Los ácidos de carbono que pueden desprotonarse mediante amida sódica en amoniaco líquido incluyen alquinos terminales,[14] metilcetonas,[15] ciclohexanona,[16] ácido fenilacético y sus derivados[17] y difenilmetano.[18] La acetilacetona pierde dos protones para formar un dianión.[19] La amida sódica también desprotonará el indol[20] y la piperidina.[21]
Bases no nucleófilas relacionadas
[editar]Sin embargo, es poco soluble en disolventes distintos del amoníaco. Su uso ha sido sustituido por los reactivos relacionados hidruro sódico, bis(trimetilsilil)amida sódica (NaHMDS) y diisopropilamida de litio (LDA).
Otras reacciones
[editar]- Reorganización con ortodeprotonación[22]
- Síntesis de oxirano[23]
- Síntesis del indol[24]
- Reacción de Chichibabin
Seguridad
[editar]La amida de sodio se descompone violentamente en contacto con el agua, produciendo amoníaco e hidróxido de sodio:
- NaNH
2 + H
2O → NH
3 + NaOH
Cuando se quema en oxígeno, dará óxidos de sodio (que reaccionan con el agua producida, dando hidróxido de sodio) junto con óxidos de nitrógeno:
- 4 NaNH
2 + 5 O
2 → 4 NaOH + 4 NO + 2 H
2O
- 4 NaNH
2 + 7 O
2 → 4 NaOH + 4 NO
2 + 2 H
2O
En presencia de cantidades limitadas de aire y humedad, como en un recipiente mal cerrado, pueden formarse mezclas explosivas de peróxidos.[25] Esto va acompañado de un amarilleamiento o pardeamiento del sólido. Por ello, la amida sódica debe almacenarse en un recipiente herméticamente cerrado, bajo una atmósfera de gas inerte. Las muestras de amida sódica de color amarillo o marrón representan riesgos de explosión.
Referencias
[editar]- ↑ Número CAS
- ↑ Bergstrom, F. W. (1955). "Sodium amide". Org. Synth.; Coll. Vol. 3: 778.
- ↑ Greenlee, K. W.; Henne, A. L. (1946). «Sodium Amide». Inorganic Syntheses. Inorganic Syntheses 2. pp. 128-135. ISBN 9780470132333. doi:10.1002/9780470132333.ch38.
- ↑ Wells, A. F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Zalkin, A.; Templeton, D. H. (1956). «The Crystal Structure Of Sodium Amide». Journal of Physical Chemistry 60 (6): 821-823. doi:10.1021/j150540a042. hdl:2027/mdp.39015086484659.
- ↑ L. Lange, W. Treibel "Sodium Amide" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a24_267
- ↑ Campbell, K. N.; Campbell, B. K. (1950). "Phenylacetylene". Org. Synth. 30: 72; Coll. Vol. 4: 763.
- ↑ Jones, E. R. H.; Eglinton, G.; Whiting, M. C.; Shaw, B. L. (1954). "Ethoxyacetylene". Org. Synth. 34: 46; Coll. Vol. 4: 404. Bou, A.; Pericàs, M. A.; Riera, A.; Serratosa, F. (1987). "Dialkoxyacetylenes: di-tert-butoxyethyne, a valuable synthetic intermediate". Org. Synth. 65: 58; Coll. Vol. 8: 161. Magriotis, P. A.; Brown, J. T. (1995). "Phenylthioacetylene". Org. Synth. 72: 252; Coll. Vol. 9: 656. Ashworth, P. J.; Mansfield, G. H.; Whiting, M. C. (1955). "2-Butyn-1-ol". Org. Synth. 35: 20; Coll. Vol. 4: 128.
- ↑ Newman, M. S.; Stalick, W. M. (1977). "1-Ethoxy-1-butyne". Org. Synth. 57: 65; Coll. Vol. 6: 564.
- ↑ Salaun, J. R.; Champion, J.; Conia, J. M. (1977). "Cyclobutanone from methylenecyclopropane via oxaspiropentane". Org. Synth. 57: 36; Coll. Vol. 6: 320.
- ↑ Nakamura, M.; Wang, X. Q.; Isaka, M.; Yamago, S.; Nakamura, E. (2003). "Synthesis and (3+2)-cycloaddition of a 2,2-dialkoxy-1-methylenecyclopropane: 6,6-dimethyl-1-methylene-4,8-dioxaspiro(2.5)octane and cis-5-(5,5-dimethyl-1,3-dioxan-2-ylidene)hexahydro-1(2H)-pentalen-2-one". Org. Synth. 80: 144.
- ↑ Bottini, A. T.; Olsen, R. E. (1964). "N-Ethylallenimine". Org. Synth. 44: 53; Coll. Vol. 5: 541.
- ↑ Skorcz, J. A.; Kaminski, F. E. (1968). "1-Cyanobenzocyclobutene". Org. Synth. 48: 55; Coll. Vol. 5: 263.
- ↑ Saunders, J. H. (1949). "1-Ethynylcyclohexanol". Org. Synth. 29: 47; Coll. Vol. 3: 416. Peterson, P. E.; Dunham, M. (1977). "(Z)-4-Chloro-4-hexenyl trifluoroacetate". Org. Synth. 57: 26; Coll. Vol. 6: 273. Kauer, J. C.; Brown, M. (1962). "Tetrolic acid". Org. Synth. 42: 97; Coll. Vol. 5: 1043.
- ↑ Coffman, D. D. (1940). "Dimethylethynylcarbinol". Org. Synth. 20: 40; Coll. Vol. 3: 320. Hauser, C. R.; Adams, J. T.; Levine, R. (1948). "Diisovalerylmethane". Org. Synth. 28: 44; Coll. Vol. 3: 291.
- ↑ Vanderwerf, C. A.; Lemmerman, L. V. (1948). "2-Allylcyclohexanone". Org. Synth. 28: 8; Coll. Vol. 3: 44.
- ↑ Hauser, C. R.; Dunnavant, W. R. (1960). "α,β-Diphenylpropionic acid". Org. Synth. 40: 38; Coll. Vol. 5: 526. Kaiser, E. M.; Kenyon, W. G.; Hauser, C. R. (1967). "Ethyl 2,4-diphenylbutanoate". Org. Synth. 47: 72; Coll. Vol. 5: 559. Wawzonek, S.; Smolin, E. M. (1951). "α,β-Diphenylcinnamonitrile". Org. Synth. 31: 52; Coll. Vol. 4: 387.
- ↑ Murphy, W. S.; Hamrick, P. J.; Hauser, C. R. (1968). "1,1-Diphenylpentane". Org. Synth. 48: 80; Coll. Vol. 5: 523.
- ↑ Hampton, K. G.; Harris, T. M.; Hauser, C. R. (1971). "Phenylation of diphenyliodonium chloride: 1-phenyl-2,4-pentanedione". Org. Synth. 51: 128; Coll. Vol. 6: 928. Hampton, K. G.; Harris, T. M.; Hauser, C. R. (1967). "2,4-Nonanedione". Org. Synth. 47: 92; Coll. Vol. 5: 848.
- ↑ Potts, K. T.; Saxton, J. E. (1960). "1-Methylindole". Org. Synth. 40: 68; Coll. Vol. 5: 769.
- ↑ Bunnett, J. F.; Brotherton, T. K.; Williamson, S. M. (1960). "N-β-Naphthylpiperidine". Org. Synth. 40: 74; Coll. Vol. 5: 816.
- ↑ Brazen, W. R.; Hauser, C. R. (1954). "2-Methylbenzyldimethylamine". Org. Synth. 34: 61; Coll. Vol. 4: 585.
- ↑ Allen, C. F. H.; VanAllan, J. (1944). "Phenylmethylglycidic ester". Org. Synth. 24: 82; Coll. Vol. 3: 727.
- ↑ Allen, C. F. H.; VanAllan, J. (1942). "2-Methylindole". Org. Synth. 22: 94; Coll. Vol. 3: 597.
- ↑ Clark, Donald E (2001). «Peroxides and peroxide-forming compounds». Chemical Health and Safety 8 (5): 12-22. ISSN 1074-9098. doi:10.1016/S1074-9098(01)00247-7.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Sodium amide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.